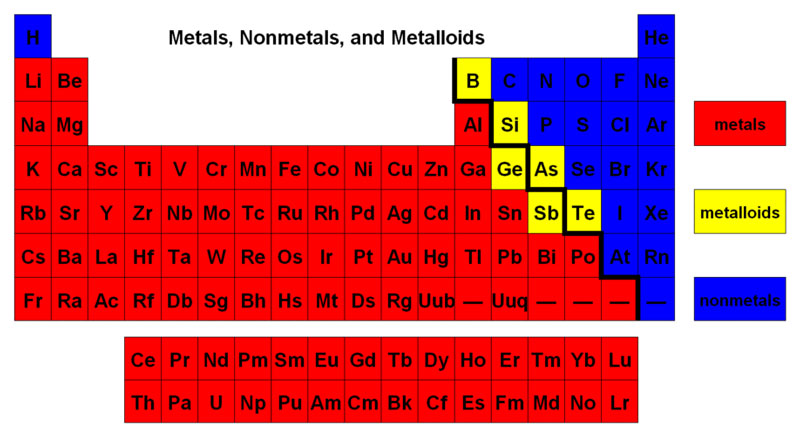
Các nguyên tố có thể được phân loại là kim loại, phi kim hoặc á kim. Kim loại là chất dẫn nhiệt và điện tốt, đồng thời dẽ uốn (rèn thành tấm) và dẻo (kéo thành dây). Hầu hết các kim loại là chất rắn ở nhiệt độ phòng, có ánh bạc đặc trưng (ngoại trừ thủy ngân là chất lỏng).
Vị trí của kim loại, phi kim, á kim trong bảng tuần hoàn hóa học
Phi kim thường là chất dẫn điện và nhiệt kém, không dễ uốn hoặc kéo sợi, nhiều phi kim là chất khí ở nhiệt độ phòng. Trong khi một số chất khác là lỏng hoặc rắn.
Các á kim là trung gian trong tính chất của chúng. Về tính vật lý, chúng giống phi kim hơn, nhưng trong một số trường hợp nhất định, một vài trong số chúng có thể dẫn điện. Những chất bán dẫn này cực kỳ quan trọng trong máy tính và các thiết bị điện tử khác.
Trên nhiều bảng tuần hoàn, một đường màu đen có răng cưa (xem hình bên dưới) dọc theo phía bên phải của đường phân tách kim loại với phi kim. Các kim loại nằm ở bên trái của vạch (ngoại trừ hydro là phi kim), các á kim nằm ở bên phải của vạch và các nguyên tố ngay sát vạch là á kim.
Khi các nguyên tố kết hợp để tạo thành hợp chất. có hai loại liên kết chính có thể xảy ra. Liên kết ion hình thành khi có sự chuyển electron từ nguyên tử này sang nguyên tử khác. Tạo ra các ion điện tích hút nhau rất mạnh bằng tương tác tĩnh điện và liên kết cộng hóa trị. Tạo ra khi các nguyên tử chia sẻ electron để tạo ra các phân tử trung hòa.
Nói chung, kim loại và phi kim dễ kết hợp với nhau để tạo thành hợp chất ion, trong khi phi kim kết hợp với phi kim khác để tạo thành hợp chất cộng hóa trị (phân tử).
Vị trí của kim loại trong bảng tuần hoàn hóa học
Vì các kim loại nằm xa hơn về phía bên trái của bảng tuần hoàn, vậy nên chúng có năng lượng ion hóa thấp và ái lực với electron thấp. Vì vậy chúng mất electron tương đối dễ dàng và khó thu được electron.
Chúng cũng có tương đối ít electron hóa trị và có thể tạo thành ion (thỏa mãn quy tắc bát tử) dễ dàng hơn bằng cách mất đi các electron hóa trị để tạo thành cation tích điện dương.
Các kim loại nhóm chính thường tạo thành các điện tích giống như số nhóm của chúng. Nghĩa là các kim loại nhóm 1A như natri và kali tạo thành điện tích +1, các kim loại nhóm 2A như magie và canxi tạo thành điện tích +2. Các kim loại nhóm 3A như nhôm tạo thành điện tích 3+.
Vị trí của á kim trong bảng tuần hoàn hóa học
Các kim loại theo sau các kim loại chuyển tiếp (về phía dưới cùng của nhóm 4A và 5A) có thể mất đi các electron s và p lớp ngoài cùng của chúng. Tạo thành các điện tích giống hệt với số nhóm của chúng hoặc chỉ mất đi các electron p trong khi vẫn giữ hại hai s. Các electron tạo thành điện tích bằng số nhóm trừ đi hai.
Nói cách khác, thiếc và chi trong nhóm 4A có thể tạo thành điện tích + 4 hoặc + 2. Trong khi bismuth nhóm 5A có thể tạo thành điện tích 5+ hoặc 3+.
Các kim loại chuyển tiếp thường có khả năng tạo thành điện tích 2+ bằng cách mất đi các electron hóa trị của chúng. Nhưng cũng có thể mất đi các electron từ quỹ đại d của chúng để tạo thành các điện tích khác.
Hầu hết các kim loại chuyển tiếp có thể hình thành nhiều hơn một hóa trị trong các hợp chất ion.
Vị trí của phi kim trong bảng tuần hoàn hóa học
Các phi kim nằm xa hơn về phía bên phải của bảng tuần hoàn và có năng lượng ion hóa cao và ái lực electron cao. Vì vậy chúng thu các electron tương đối dễ và khó mất chúng. Chúng cũng có số lượng electron hóa trị lớn hơn và đã gần đạt bộ tám hoàn chỉnh.
Các phi kim nhận electron cho đến khi chúng có cùng số electron với khí hiếm gần nhất (nhóm 8A). Tạo thành các anion điện tích âm có điện tích bằng tám từ đi số nhóm.
Nghĩa là, phi kim nhóm 7A tạo thành 1 điện tích, phi kim nhóm 6A tạo thành 2 điện tích và kim loại nhóm 5A tạo thành 3 điện tích. Các nguyên tố nhóm 8A đã có tám electron trong lớn vỏ hóa trị của chúng và có rất ít xu hướng nhận hoặc mất electron. Và không dễ dàng tạo thành các hợp chất ion hoặc cộng hóa trị.
Các loại liên kết của kim loại, phi kim, á kim
Các hợp chất ion được liên kết với nhau thành một mảng thông thường được gọi là mạng tinh thể bởi lực hút giữa các cation và anion tích điện trái dấu. Các lực hấp dẫn này rất mạnh và do đó hầu hết các hợp chất ion đều có điểm nóng chảy rất cao (Ví dụ: natri clorua, NaCl, nóng chảy ở 801 độ, trong khi nhôm oxit, Al2O3, nóng chảy ở 2054 độ).
Các hợp chất ion thường cứng, rắn chắc và giòn. Các hợp chất ion không dẫn điện, vì các ion không tự do di chuyển trong pha rắn, nhưng các hợp chất ion có thể dẫn điện khi chúng hòa tan trong nước.
Khi các phi kim kết hợp với các phi kim khác, chúng có xu hướng chia sẻ các electron trong liên kết cộng hóa trị thay vì tạo thành các ion, dẫn đến sự hình thành các phân tử trung tính. (Hãy nhớ rằng vì hydro cũng là một phi kim nên sự kết hợp của hydro với một phi kim khác cũng sẽ tạo ra liên kết cộng hóa trị).
Các hợp chất phân tử có thể là chất khí, dạng lỏng hoặc chất rắn có điểm nóng chảy thấp và bao gồm nhiều loại chất khác nhau.
Khi các kim loại kết hợp với nhau, liên kết đó thường được mô tả là liên kết kim loại. Trong mô hình này, mỗi nguyên tử kim loại tặng một hoặc nhiều electron hóa trị của nó để tạo ra một biển electron bao quanh tất cả các nguyên tử, giữ chất này lại với nhau bằng lực hút giữa các cation kim loại và các electron mang điện tích âm.
Vì các electron trong biển electron có thể di chuyển tự do nên kim loại dẫn điện rất dễ dàng, không giống như các phân tử, nơi các electron được cố định nhiều hơn.
Các nguyên tử kim loại có thể di chuyển qua nhau dễ dàng hơn so với các nguyên tử trong hợp chất ion (được giữ cố định bởi lực hút giữa cation và anion), cho phép kim loại được dập thành tấm hoặc kéo dây.
Các kim loại khác nhau có thể được kết hợp rất dễ dàng để tạo ra hợp kim, có thể có nhiều tính chất vật lý khác với các kim loại cấu thành của chúng.
Thép là hợp kim của sắt và cacbon, cứng hơn nhiều so với bản thân sắt. Crom, vanadi, niken và các kim loại khác cũng thường được thêm vào sắt để tạo ra các loại thép. Đồng thau cũng là một hợp kim của đồng và kẽm được sử dụng trong đường ống, thiết bị điện, nhạc cụ.
Đồng đỏ là hợp kim của đồng và thiếc, cứng hơn nhiều so với đồng. Khi đồ đồng được phát hiện bởi các nền văn minh cổ đại, nó đã đánh dấu một bước tiến đáng kể so với việc sử dụng các công cụ bằng đá kém bền hơn.
Bài viết liên quan:
- Kim loại nhóm 2a (IIA) trong bảng tuần hoàn hóa học
- Các kim loại nhóm 1a (IA) trong bảng tuần hoàn hóa học








 lý tư thư
lý tư thư







